El riesgo de tromboembolismo venoso en el paciente hospitalizado no quirúrgico: "Una nueva estrategia para una vieja enemiga"
The risk of venous thromboembolism in the non-surgical hospitalized patient: "A new strategy for an old enemy"
Muñoz Rossi, F1; Puentes Rodríguez C2; Ricardo Ossio G3; Pico Barrios F4; Guzmán Figueredo L4.
1. Facultad de Medicina interna, Universidad Nacional de Colombia, Bogotá, Colombia
2. Facultad de Medicina, Universidad de los Andes, Bogotá, Colombia
3. Clínica laser de piel, Bogotá, Colombia
4. SURA IPS, Bogotá, Colombia
Palabras clave: trombosis venosa,
tromboembolismo pulmonar,
profilaxis,
prevención.
Keywords: venous thrombosis,
pulmonary thromboembolism,
prophylaxis,
prevention.
Resumen
Los eventos tromboembólicos ocupan los primeros lugares de morbimortalidad prevenibles en los pacientes hospitalizados, así como también representan un aumento en la carga financiera y asistencial en los sistemas de salud. La aplicación de tromboprofilaxis en pacientes de manejo médico se implementa de forma subóptima debido al temor a presentar sangrado o por subestimación del riesgo de eventos trombóticos. La aplicación de herramientas para la estimación del riesgo de eventos tromboembólicos se plantea como una ayuda en la toma de la decisión de iniciar o no estrategias de tromboprofilaxis en pacientes hospitalizados con el objetivo de disminuir la incidencia y prevalencia de estos eventos, así como la morbimortalidad asociada.
Abstract
Thromboembolic events occupy the first places of preventable morbidity and mortality in hospitalized patients as well as represent an increase in the financial and care burden on health systems. The application of thromboprophylaxis in medically managed patients is implemented suboptimally due to fear of bleeding or due to underestimation of the risk of thrombotic events. The application of tools for estimating the risk of thromboembolic events is proposed as an aid in making the decision to initiate or not thromboprophylaxis strategies in hospitalized patients with the aim of reducing the incidence and prevalence of these events as well as the associated morbidity and mortality. .
Método
Se realizó una revisión no sistemática de la evidencia publicada en algunas bases de datos como: Medline, PubMed, Google Scholar, EBSCO, entre otras. Se utilizaron palabras clave y términos MeSh.
Introducción
Los eventos tromboembólicos venosos (TEV) como trombosis venosa profunda (TVP) y tromboembolismo pulmonar (TEP) pueden ser consideradas como unas de las causas de morbimortalidad prevenibles más importantes en el paciente hospitalizado. Son causantes de más muertes al año que las ocasionadas por cáncer de mama, virus de la inmunodeficiencia humana (VIH) y los accidentes de tránsito combinados, todo esto sin asociar los costos relacionados con TEV y su relación con el síndrome postrombótico. que aumenta la morbilidad, los reingresos y, por consiguiente, significa una carga financiera para los sistemas de salud(1).
Se ha evidenciado que entre un 25 y un 39% de los episodios de TEV ocurren en los tres meses posteriores a una hospitalización(2,3). La incidencia de TVP en el ambiente intrahospitalario es del 15% aproximadamente. Adicionalmente se ha demostrado que el tromboembolismo pulmonar agudo es el responsable de entre el 5 y el 10% de todos los fallecimientos intrahospitalarios, siendo esta la primera causa de muerte prevenible en el paciente hospitalizado(4).
Los principales factores de riesgo para la TEV son las cirugías recientes, traumatismo en extremidades inferiores, historia de inmovilización por hospitalización prolongada, obesidad, primer episodio de TEV, malignidad, uso de anticoncepción oral, terapia de reemplazo hormonal, embarazo o puerperio y el accidente isquémico cerebral. Todos los factores de riesgo anteriores obedecen a favorecer la triada de Virchow (estasis sanguínea, daño endotelial e hipercoagulabilidad) como evento fisiopatológico desencadenante de estas condiciones(4). En el 80% de los pacientes con trombosis venosa aguda se puede identificar un factor de riesgo prevenible asociado a la aparición del evento(5).
Esta revisión tiene como objetivo recopilar la mejor evidencia hasta la fecha para su aplicación correcta en la identificación de pacientes adultos que deban ser considerados para tromboprofilaxis farmacológica, con patología no quirúrgica de manejo médico, sin antecedentes patológicos previos que requieran anticoagulación. Se excluyen de esta revisión pacientes que requieran algún tipo de intervención quirúrgica, pacientes de obstetricia y pacientes con antecedentes cardiovasculares.
Tromboprofilaxis venosa
La tromboprofilaxis en el paciente hospitalizado continúa siendo un reto debido a que esta población tiende a ser de mayor edad, con múltiples enfermedades crónicas en manejo farmacológico que aumentan el riesgo de presentar interacciones medicamentosas con los fármacos anticoagulantes(6,7). Las auditorías globales en población latinoamericana evidencian una subutilización de tromboprofilaxis por los clínicos en el paciente hospitalizado, principalmente porque se tiene una percepción de alto riesgo de sangrado o de bajo riesgo de TEV(8). Por otro lado, estudios recientes indican que el abordaje de una tromboprofilaxis “universal” no reduce el riesgo de TVE en la población objeto y aumenta el riesgo de sangrado en pacientes hospitalizados(9,10). Así mismo durante el período de alta inmediata del paciente hospitalizado de manejo médico no se reduce la probabilidad de riesgo de TVE(11). Por ello resulta preciso estratificar a cada paciente según el riesgo para presentar eventos tromboembólicos para definir, en base en esta clasificación, la necesidad de tromboprofilaxis farmacológica
Riesgo de tromboembolismo venoso en el paciente médico hospitalizado
Para evaluar de forma adecuada el riesgo de TVE es relevante dividir tal riesgo en 3 períodos, lo cual puede ayudar a crear una perspectiva no sólo del riesgo sino de la utilidad de la estrategia trombo profiláctica(12).
• Período agudo de hospitalización (6-14 días). Éste representa el período de mayor riesgo de presentar TEV que depende principalmente del grado de inmovilidad y severidad de la enfermedad por la cual ingresa el paciente, puede deberse a una exacerbación aguda de una enfermedad crónica. La incidencia de episodios tromboembólicos durante este período varía entre 10% a 26%(13,14). Así mismo la mayoría de TEV son asintomáticas. Hasta en un 55% de los pacientes que presentan episodios de TEV presentan un antecedente reciente de isquemia cerebral, falla cardíaca o EPOC(15,16) y hasta un 75% de los TEP ocurren en población hospitalizada por enfermedades de manejo médico(17).
Estudios controlados por placebo con heparina de bajo peso molecular (HBPM) y pentasacárido fondaparinux demostraron una reducción de aproximadamente el 50% de TEV con una duración de 14 días(18–20), con evidencia adicional de reducción del 60% en cualquier TEP incluyendo los eventos fatales. Sin embargo, la tromboprofilaxis no tuvo efecto en la mortalidad por cualquier causa(21).
• Período de alta posterior a la hospitalización (hasta los 45 días posteriores al egreso). Puede extenderse hasta 90 días posteriores al ingreso. Es de riesgo para desarrollo de TEV, siendo los primeros 45 días los de mayor probabilidad con un 80% de los casos siendo ocasionados bien sea por exacerbación de enfermedad crónica o por los factores de riesgo intrahospitalarios para presentar TEV(11). En estos pacientes es pertinente evaluar la tromboprofilaxis extendida (hasta 45 días). Cuatro estudios compararon duración corta (6 a 14 días) frente a duración extendida de la tromboprofilaxis. que en este último grupo estuvo asociada a una disminución TVP sintomática proximal o distal (RR: 0.52) y de TEP sintomático no fatal. (RR: 0.61)(22). Sin embargo, se evidenció un riesgo incrementado de dos veces más de sangrado mayor(22,23).
• Período de enfermedad crónica. En este período el riesgo de TEV depende de la condición crónica del paciente y de su estado funcional(12). Algunas patologías, como la enfermedad cerebro vascular isquémica, falla cardíaca, EPOC, infecciones de inicio reciente, enfermedad inflamatoria intestinal y reumática, están asociadas a un alto riesgo de TEV durante este período(2).
Individualización del riesgo de eventos tromboembólicos en los pacientes hospitalizados
La tromboprofilaxis es implementada de forma deficiente sin tener en cuenta los diferentes períodos de riesgo de TEV de los pacientes, motivo por el cual ha surgido la necesidad del desarrollo de modelos de evaluación para medir el riesgo en los pacientes hospitalizados en manejo médico. Aquellas herramientas ayudan a la toma de decisiones clínicas para estratificar el riesgo de TEV en pacientes, mejorando el uso de la tromboprofilaxis en la población de riesgo(23). Kucher y col lograron demostrar que el uso de tales herramientas incrementó el uso de la tromboprofilaxis permitiendo una reducción de las tasas de TEV en pacientes hospitalizados(24).
Durante una revisión sistemática se encontró que sólo los modelos de riesgo de Padua e IMPROVE contaban con una validación externa amplia, mientras que UK National Health Service (NHS) presenta una evaluación de resultados amplia(11,25,26).
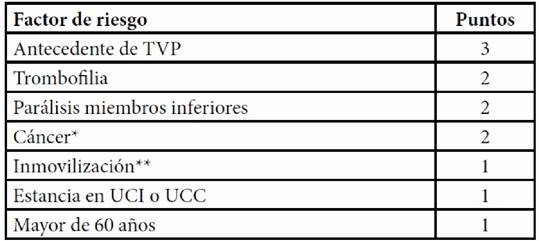
El modelo de Padua usa 11 factores con una puntuación individual entre 1-3, donde el riesgo se considera alto con un puntaje superior a 4, por lo que en ese caso se considera al paciente candidato para profilaxis farmacológica. Con un puntaje entre 1 y 3 se considera un riesgo bajo para TEV (Tabla 1)(25).
Tabla 1. Puntaje Padua: puntuación entre 1-3, donde el riesgo alto se determina con un puntaje superior a 4

El modelo IMPROVE utiliza siete factores de riesgo clínico asociados independientemente a TEV donde toma en cuenta la severidad de la condición de hospitalización en base a la admisión en la unidad de cuidado intensivo (UCI) o la unidad de cuidado coronario (UCC)(27). El modelo usa uno a tres puntos para estimar el riesgo de TEV en tres categorías: bajo riesgo de TEV (TEV sintomático < 1%) asignado con un puntaje de 0-1, riesgo moderado de TEV con eventos entre 1 y 1.5% son designados con una puntuación de 2 a 3, y riesgo alto de TEV con probabilidad de sufrir un TEV sintomático del 4% o más designado con puntaje de 4 o más (Tabla 2)(12).
Tabla 2. IMPROVE puntaje: bajo riesgo de TEV asignado con un puntaje de 0-1, riesgo moderado de TEV son designados con una puntuación de 2 a 3, y alto riesgo de TEV con probabilidad de sufrir un TEV sintomático del 4% o más designado con puntaje de 4 o más.
Todos los modelos clínicos de riesgo TEV en la población hospitalizada en manejo médico, como Padua e IMPROVE, sugieren que se están cometiendo dos errores cuando establecemos una estrategia profiláctica amplia “universal” o por “grupos” como es sugerido frecuentemente, principalmente por la guía antitrombótica(27).
Los modelos apuntan contundentemente (con valores predictivos negativos alrededor de 99%) al hecho de que sólo aproximadamente el 35-50% de la población hospitalizada tiene un riesgo de TEV suficiente para justificar la tromboprofilaxis farmacológica, utilizando la tasa de eventos sintomáticos de TEV 1% como umbral clínico sugerido, por el cual los beneficios superan el riesgo de sangrado(11,25,28). Los modelos también sugieren que, dependiendo del punto de corte que se utilice, aproximadamente el 10-25% de esta población objeto tiene un riesgo alto de TEV(11,25,28). Por lo tanto, es muy probable que exista un exceso en el manejo profiláctico de hasta un 65% de los pacientes que realmente tiene un riesgo bajo de TEV y adicionalmente subestimemos el manejo profiláctico hasta un 25% de los pacientes con riesgo alto de TEV, predominantemente por una duración corta de la tromboprofilaxís, especialmente en el período de alta hospitalaria(29).
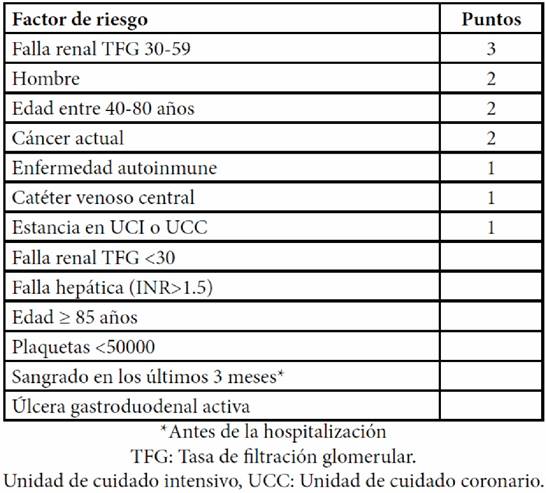
Actualmente sólo disponemos de un modelo de riesgo de sangrado para esta población, que utiliza el mismo sistema de puntaje que su contraparte para riesgo de TEV: IMPROVE bleed RAM(30) IMPROVE bleed (Tabla 3) usa 13 factores clínicos y de laboratorio, por el cual una puntuación de 7 o más identifica a la población objeto con un alto riesgo de sangrado (4.1% vs 0.4%)(30). Este modelo fue validado en una cohorte de 12000 pacientes, con una buena distribución de características de la población de estudio(31).
Tabla 3. IMPROVE BLEED: puntuación de 7 o más identifica a la población objeto con un alto riesgo de sangrado (4.1% vs 0.4%)
Actualmente ambos modelos de riesgo para TEV (IMPROVE y Padua) y el modelo de riesgo de sangrado (IMPROVE bleed) pueden ser usados al ingreso y ayudar así a determinar el riesgo individual de presentar un TEV y un sangrado mayor, siendo dentro de la medida “centrada en el paciente” al momento de tomar una conducta de tromboprofilaxis menos “universal” o “grupal”.
Concluyendo, pacientes con un puntaje de Padua de 4 o más, IMPROVE TEV de 2 o más, con un puntaje de IMPROVE bleed ≤ 7, debe garantizarse la profilaxis farmacológica durante su estancia hospitalaria. Mientras que aquéllos con una IMPROVE bleed de 7 o más puntos deberá recibir probablemente una profilaxis mecánica con dispositivos o medidas de compresión.
Otra herramienta que permite establecer el diagnóstico de episodios trombóticos es el dímero D, un biomarcador producto de la degradación de la fibrina que se eleva a más de tres veces su valor de referencia en eventos tromboembólicos, dándole una alta sensibilidad(32). Sin embargo, dicho marcador carece de especificidad al presentar alteraciones de su valor en otras condiciones médicas que también aumentan el riesgo de eventos tromboembólicos, como el cáncer, los traumas, las gestaciones de alto riesgo, la edad avanzada y los estados posoperatorios(33). Dicho marcador presenta un mayor rendimiento para excluir mas no para diagnosticar eventos tromboembólícos, por lo que la recomendación producto de diversos ensayos concluye en medir dicho marcador en un escenario clínico donde el TEV sea una opción diagnóstica con una baja probabilidad y cuando no exista una condición preexistente que pueda arrojar un resultado positivo(34).
Sin embargo, el estudio PROLONG del 2008 demostró la utilidad del dímero D para estimar el riesgo de recurrencia de TEV en pacientes con antecedente de dicho evento una vez se suspende el tratamiento anticoagulante con antagonistas de la vitamina K(35). La revisión sistemática realizada por Verhovsek y colaboradores en 2008 evidenció que los pacientes con valores de dímero D aumentados al valor de referencia ajustado a la edad tienen hasta dos veces más riesgo de presentar TEV durante los doce meses siguientes(36). Estudios más recientes evidencian que tras la suspensión de los antagonistas de vitamina K los niveles aumentados de dímero D posteriores a un mes son predictores de recurrencia de dichos eventos con un HR de 3.3 (95% CI 1.8–6.1)(37). Adicionalmente basta señalar que dicho marcador tiene mayor rendimiento en episodios de TEV no provocado y no ha demostrado mayor utilidad en episodios de TEV provocado cuya causa se ha resuelto(38).
Conclusiones
Los eventos tromboembólicos venosos son enfermedades con una alta morbi-mortalidad, representan una carga importante para los sistemas de salud y representan la principal causa de muerte prevenible en los pacientes hospitalizados. Sin embargo, la aplicación de estrategias universales de tromboprofilaxis acarrea muchos riesgos para los pacientes que muchas veces no se justifica. Por lo cual se han desarrollado múltiples herramientas para la detección e individualización del riesgo de TEV en los pacientes buscando aplicar protocolos de tromboprofilaxis indicados de forma pertinente disminuyendo así el riesgo de sangrado y complicaciones en estos pacientes.
Sin embargo, dichas herramientas se utilizan de forma subóptima, bien sea por subestimación del riesgo tromboembólico de los pacientes o por sobre estimación de las complicaciones inherentes a la tromboprofilaxis farmacológica, por lo que resulta preciso el esfuerzo de los centros hospitalarios en la implementación de dichas herramientas con el objetivo de iniciar tromboprofilaxis guiados por elementos de juicio que permitan particularizar qué estrategia resulta más benéfica para el paciente y así disminuir la incidencia y la recurrencia de estos eventos de forma razonada sin que sea el criterio clínico el único elemento de juicio para el inicio de dicha prevención.
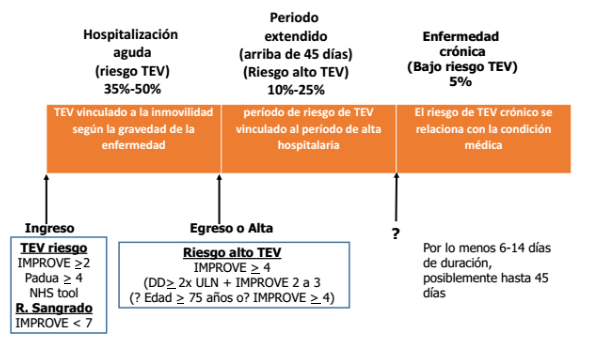
Figura 1. tromboprofilaxis individualizada en pacientes médicos hospitalizados. Tomado de: Spyropoulos AC, & Raskob GE. Thromb Haemost. 2017; 117: 1662-70.
Conflictos de interes: Los autores declaran no poseer conflictos de interes.
Bibliografía
1. Ye F, Bell LN, Mazza J, Lee A, Yale SH. Variation in Definitions of Immobility in Pharmacological Thromboprophylaxis Clinical Trials in Medical Inpatients: A Systematic Review. Clin Appl Thromb Hemost. 2018 Jan;24(1):13-21.
2. Heit JA, Ashrani A, Crusan DJ, McBane RD, Petterson TM, Bailey KR. Reasons for the persistent incidence of venous thromboembolism. Thromb Haemost. 2017 Jan 26;117(2):390-400.
3. Spencer FA, Emery C, Lessard D, Anderson F, Emani S, Aragam J et al. The Worcester Venous Thromboembolism study: a population-based study of the clinical epidemiology of venous thromboembolism. J Gen Intern Med. 2006 Jul;21(7):722-7.
4. Douketis JD. Prevention of venous thromboembolism in hospitalized medical patients: addressing some practical questions: Curr Opin Pulm Med. 2008 Sep;14(5):381-8.
5. Marušič AP, Locatelli I, Mrhar A, Caprnda M, Gaspar L, Adamek M et al. Influence of Prescribed Blood Products on the Incidence of Deep Vein Thrombosis and Pulmonary Embolism in Surgical Patients. Clin Appl Thromb. 2017 Nov;23(8):938-42.
6. Veeranki SP, Xiao Z, Levorsen A, Sinha M, Shah BR. Real-World Comparative Effectiveness and Cost Comparison of Thromboprophylactic Use of Enoxaparin versus Unfractionated Heparin in 376,858 Medically Ill Hospitalized US Patients. Am J Cardiovasc Drugs. 2021 Jul;21(4):443-452.
7. Darzi AJ, Repp AB, Spencer FA, Morsi RZ, Charide R, Etxeandia-Ikobaltzeta I, Bauer KA, Burnett AE, Cushman M, Dentali F, Kahn SR, Rezende SM, Zakai NA, Agarwal A, Karam SG, Lotfi T, Wiercioch W, Waziry R, Iorio A, Akl EA, Schünemann HJ. Risk-assessment models for VTE and bleeding in hospitalized medical patients: an overview of systematic reviews. Blood Adv. 2020 Oct 13;4(19):4929-4944.
8. Cohen AT, Tapson VF, Bergmann J-F, Goldhaber SZ, Kakkar AK, Deslandes B et al. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational cross-sectional study. Lancet Lond Engl. 2008 Feb;371(9610):387-94.
9. Mahan CE, Fisher MD, Mills RM, Fields LE, Stephenson JJ, Fu A-C et al. Thromboprophylaxis patterns, risk factors, and outcomes of care in the medically ill patient population. Thromb Res. 2013 Nov;132(5):520-6.
10. Flanders SA, Greene MT, Grant P, Kaatz S, Paje D, Lee B et al. Hospital performance for pharmacologic venous thromboembolism prophylaxis and rate of venous thromboembolism : a cohort study. JAMA Intern Med. 2014 Oct;174(10):1577-84.
11. Spyropoulos AC, Anderson FA, FitzGerald G, Decousus H, Pini M, Chong BH et al. Predictive and associative models to identify hospitalized medical patients at risk for VTE. Chest. 2011 Sep;140(3):706-14.
12. Spyropoulos AC, Raskob GE. New paradigms in venous thromboprophylaxis of medically ill patients. Thromb Haemost. 2017;117(09):1662-70.
13. MacDougall K, Spyropoulos AC. New Paradigms of Extended Thromboprophylaxis in Medically Ill Patients. J Clin Med. 2020 Apr 2;9(4):1002.
14. Cade JF. High risk of the critically ill for venous thromboembolism. Crit Care Med. 1982 Jul;10(7):448-50.
15. Nicolaides AN, Breddin HK, Fareed J, Goldhaber S, Haas S, Hull R et al. Prevention of venous thromboembolism. International Consensus Statement. Guidelines compiled in accordance with the scientific evidence. Int Angiol J Int Union Angiol. 2001 Mar;20(1):1-37.
16. Enders JM, Burke JM, Dobesh PP. Prevention of venous thromboembolism in acute medical illness. Pharmacotherapy. 2002 Dic;22(12):1564-78.
17. Cohen AT, Edmondson RA, Phillips MJ, Ward VP, & Kakkar VV. The changing pattern of venous thromboembolic disease. Haemostasis. 1996 Abr;26(2):65-71.
18. Samama MM, Cohen AT, Darmon JY, Desjardins L, Eldor A, Janbon C, Leizorovicz A, Nguyen H, Olsson CG, Turpie AG, Weisslinger N. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med. 1999 Sep 9;341(11):793-800.
19. Leizorovicz A, Cohen AT, Turpie AGG, Olsson C-G, Vaitkus PT, Goldhaber SZ et al. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation. 2004 Ago;110(7):874-9.
20. Cohen AT, Davidson BL, Gallus AS, Lassen MR, Prins MH, Tomkowski W et al. Efficacy and safety of fondaparinux for the prevention of venous thromboembolism in older acute medical patients: randomised placebo controlled trial. BMJ. 2006 Feb;332(7537):325-9.
21. Dentali F, Douketis JD, Gianni M, Lim W et Crowther MA. Meta-analysis: anticoagulant prophylaxis to prevent symptomatic venous thromboembolism in hospitalized medical patients. Ann Intern Med. 2007 Feb;146(4):278-88.
22. Liew AYL, Piran S, Eikelboom JW et Douketis JD. Extended-duration versus short-duration pharmacological thromboprophylaxis in acutely Ill hospitalized medical patients: a systematic review and meta-analysis of randomized controlled trials. J Thromb Thrombolysis. 2017 Abr;43(3):291-301.
23. Stuck A, Spirk D, Schaudt J, & Kucher N. Risk assessment models for venous thromboembolism in acutely ill medical patients: A systematic review. Thromb Haemost. 2017;117(04):801-8.
24. Kucher N, Koo S, Quiroz R, Cooper JM, Paterno MD, Soukonnikov B, Goldhaber SZ. Electronic alerts to prevent venous thromboembolism among hospitalized patients. N Engl J Med. 2005 Mar 10;352(10):969-77.
25. Barbar S, Noventa F, Rossetto V, Ferrari A, Brandolin B, Perlati M et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost JTH. 2010 Nov;8(11):2450-7.
26. Lester W, Freemantle N, Begaj I, Ray D, Wood J et Pagano D. Fatal venous thromboembolism associated with hospital admission: a cohort study to assess the impact of a national risk assessment target. Heart Br Card Soc. 2013 Dic;99(23):1734-9.
27. Tapson VF, Decousus H, Pini M, Chong BH, Froehlich JB, Monreal M et al. Venous thromboembolism prophylaxis in acutely ill hospitalized medical patients: findings from the International Medical Prevention Registry on Venous Thromboembolism. Chest. 2007 Sep;132(3):936-45.
28. Nendaz M, Spirk D, Kucher N, Aujesky D, Hayoz D, Beer JH et al. Multicentre validation of the Geneva Risk Score for hospitalised medical patients at risk of venous thromboembolism. Explicit ASsessment of Thromboembolic RIsk and Prophylaxis for Medical PATients in SwitzErland (ESTIMATE). Thromb Haemost. 2014 Mar;111(3):531-8.
29. Amin A, Spyropoulos AC, Dobesh P, Shorr A, Hussein M, Mozaffari E et al. Are hospitals delivering appropriate VTE prevention? The venous thromboembolism study to assess the rate of thromboprophylaxis (VTE start). J Thromb Thrombolysis. 2010 Abr;29(3):326-39.
30. Decousus H, Tapson VF, Bergmann J-F, Chong BH, Froehlich JB, Kakkar AK et al. Factors at admission associated with bleeding risk in medical patients: findings from the IMPROVE investigators. Chest. 2011 Ene;139(1):69-79.
31. Rosenberg DJ, Press A, Fishbein J, Lesser M, McCullagh L, McGinn T et al. External validation of the IMPROVE Bleeding Risk Assessment Model in medical patients. Thromb Haemost. 2016 30;116(3):530-6.
32. Weitz JI, Fredenburgh JC et Eikelboom JW. A Test in Context: D-Dimer. Journal of the American College of Cardiology. 2017;70(19):2411–2420.
33. Favresse J, Lippi G, Roy P-M, Chatelain B, Jacqmin H, ten Cate H et Mullier F. D-dimer: Preanalytical, analytical, postanalytical variables, and clinical applications. Critical Reviews in Clinical Laboratory Sciences. 2018;55(8):548–577.
34. Legnani C, Palareti G, Cosmi B, Cini M, Tosetto A et Tripodi A. Different cut-off values of quantitative D-dimer methods to predict the risk of venous thromboembolism recurrence: a post-hoc analysis of the PROLONG study. Haematologica. 2008;93(6):900–907.
35. Verhovsek M, Douketis JD, Yi Q, Shrivastava S, Tait RC, Baglin T et Lim W. Systematic Review: d-Dimer to Predict Recurrent Disease after Stopping Anticoagulant Therapy for Unprovoked Venous Thromboembolism. Annals of Internal Medicine. 2008 149(7):481.
36. Nagler M, ten Cate H, Prins MH et ten Cate-Hoek AJ. Risk factors for recurrence in deep vein thrombosis patients following a tailored anticoagulant treatment incorporating residual vein obstruction. Research and Practice in Thrombosis and Haemostasis. 2018;2(2):299–309.
37. Ageno W, Squizzato A, Wells PS, Büller HR et Johnson G. The diagnosis of symptomatic recurrent pulmonary embolism and deep vein thrombosis: guidance from the SSC of the ISTH. Journal of Thrombosis and Haemostasis. 2013;11(8):1597–1602
38 Baglin T, Luddington R, Brown K et Baglin C. Incidence of recurrent venous thromboembolism in relation to clinical and thrombophilic risk factors: prospective cohort study. The Lancet. 2003;362(9383):523–526.